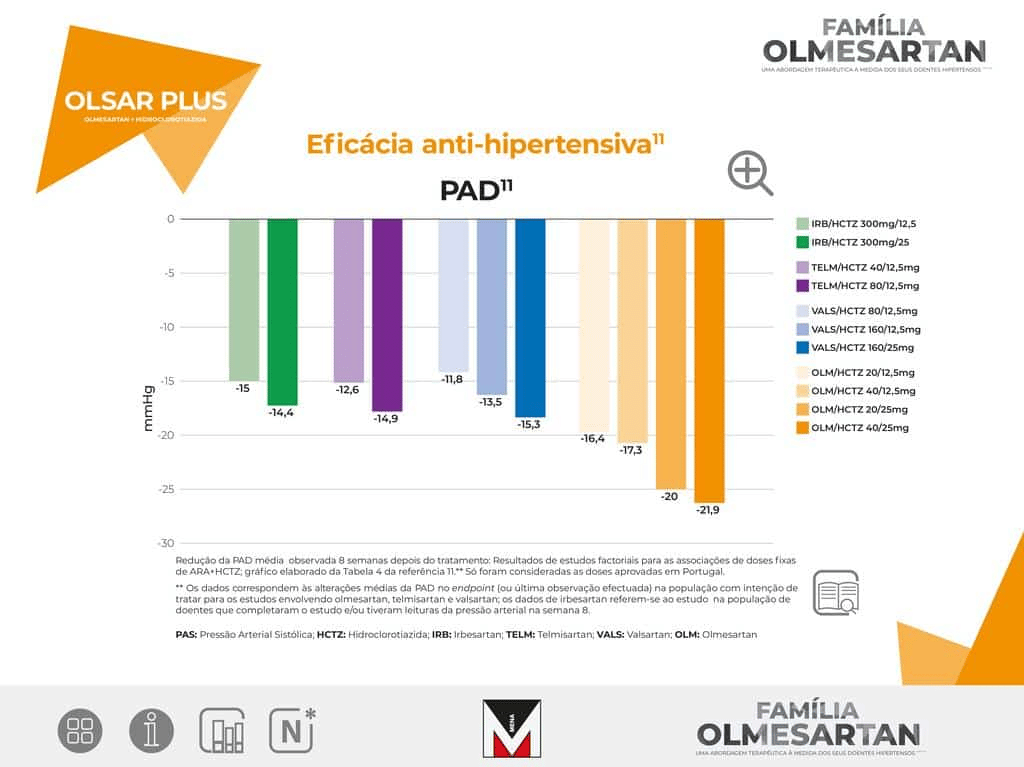
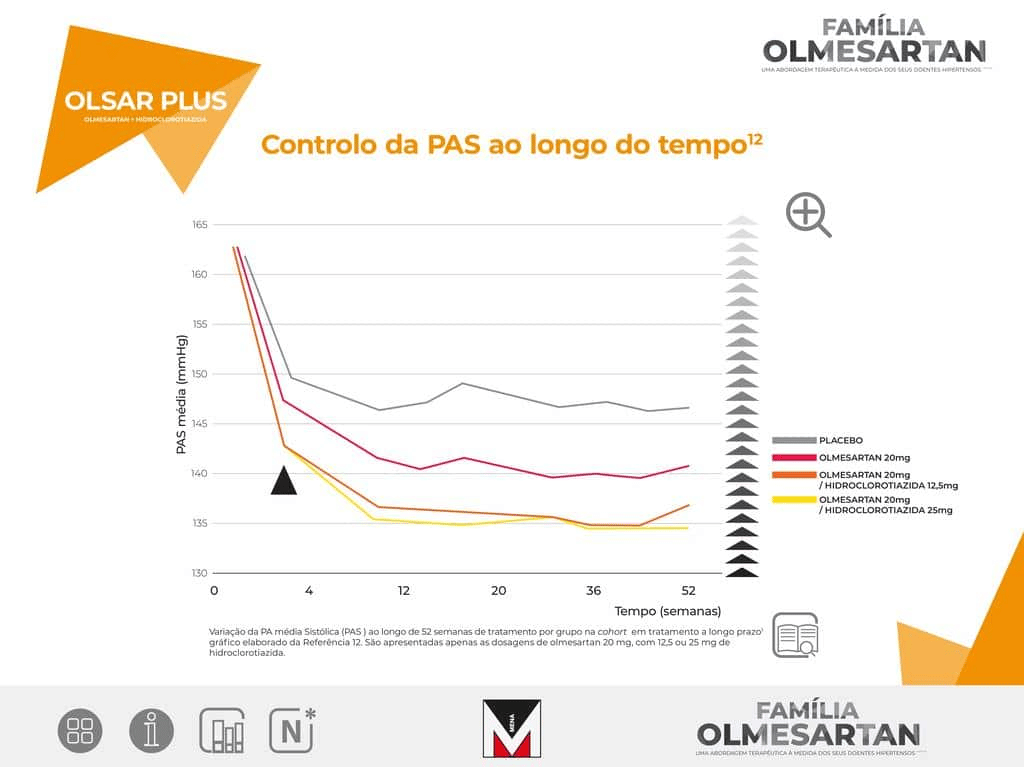
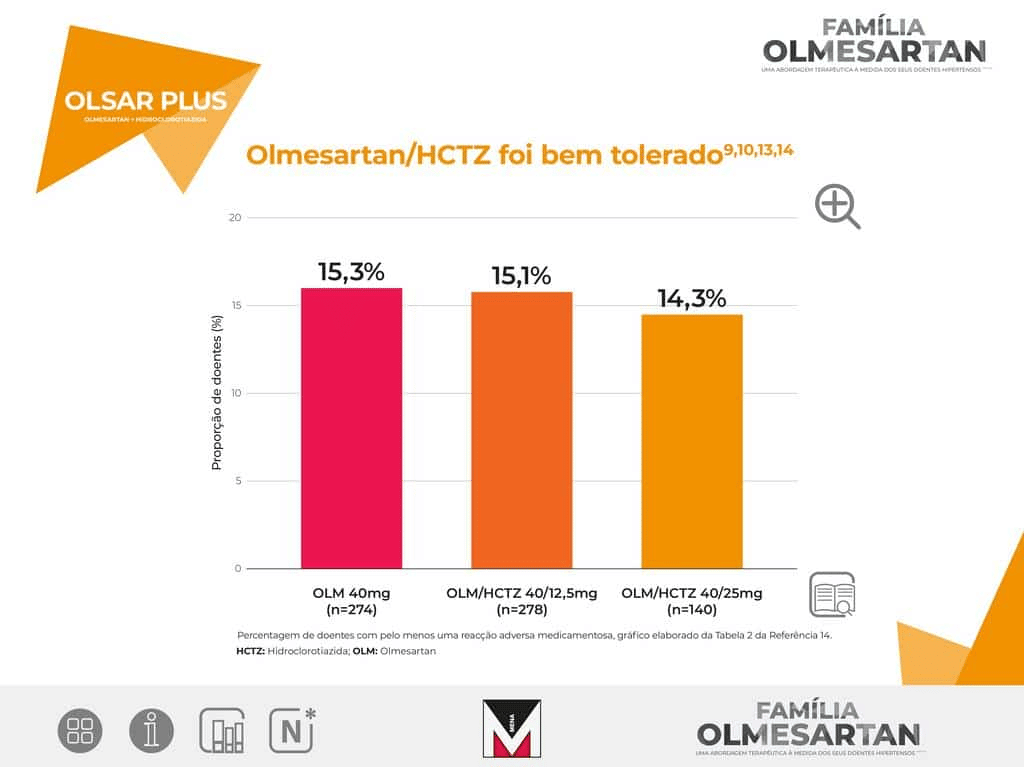
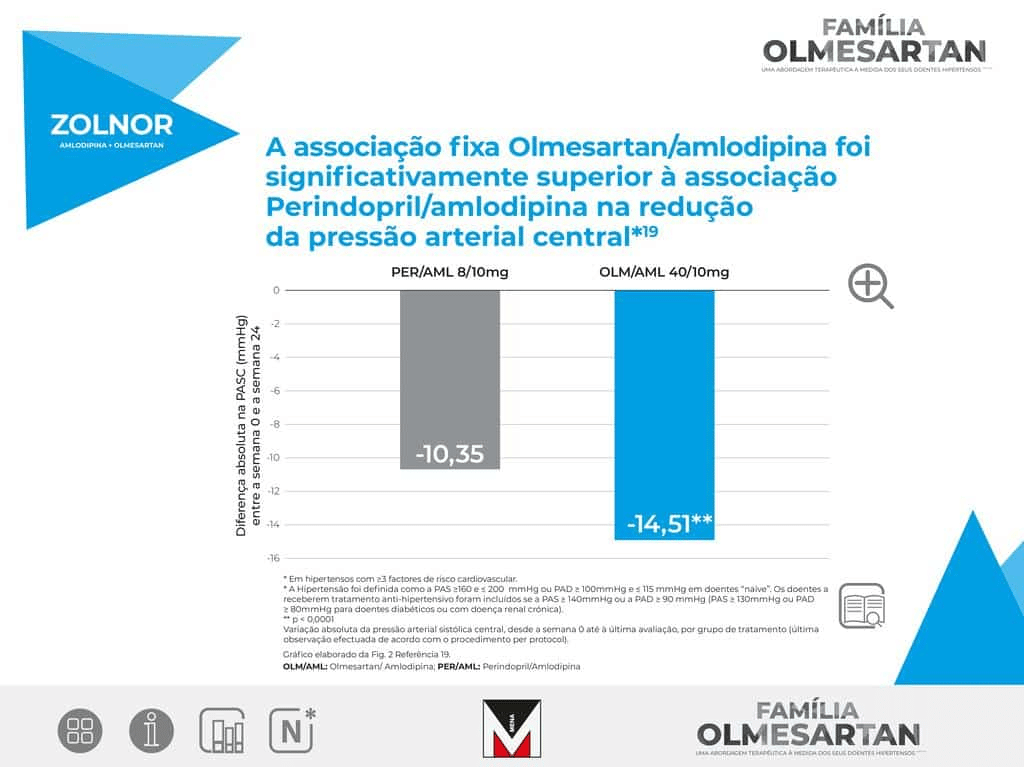
OLSAR
Informações Essenciais Compatíveis com o RCM
NOME DO MEDICAMENTO
Olsar 10 mg / 20 mg / 40 mg comprimidos revestidos por
película
COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido revestido
por
película contém 10 mg / 20 mg / 40 mg de olmesartan medoxomilo. Excipientes com efeito conhecido: Olsar
10
mg / 20 mg / 40 mg comprimidos revestidos por película: cada comprimido revestido por película contém
61,6
mg / 123,2 mg / 246,4 mg de lactose mono-hidratada.
FORMA FARMACÊUTICA
Comprimido revestido por película. Olsar 10 e 20 mg comprimidos: cor branca, forma circular, comprimidos
revestidos por película com C13 e C14 gravado num dos lados, respetivamente. Olsar 40 mg comprimidos:
cor
branca, forma oval, comprimidos revestidos por película com C15 gravado num dos lados.
INFORMAÇÕES CLÍNICAS
Indicações terapêuticas: Tratamento da
hipertensão essencial em adultos. Tratamento da hipertensão em crianças e adolescentes dos 6 anos a
menos de
18 anos de idade.
POSOLOGIA E MODO DE ADMINISTRAÇÃO: POSOLOGIA:
Adultos: A dose inicial recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia. Em
doentes
cuja tensão arterial não está adequadamente controlada com esta dose, a posologia de olmesartan
medoxomilo
pode ser aumentada para 20 mg uma vez por dia como dose ótima. Se for necessária uma maior redução da
tensão
arterial, a dose de olmesartan medoxomilo pode ser aumentada para um máximo de 40 mg uma vez por dia ou
associar-se a uma terapêutica com hidroclorotiazida. A ação anti-hipertensora do olmesartan medoxomilo é
já
evidente às 2 semanas de terapêutica e o efeito máximo atinge-se cerca de 8 semanas após o início da
terapêutica. Deve ter-se presente este facto quando se pondera a alteração do regime posológico em
qualquer
doente.
Idosos (idade igual ou superior a 65 anos): Geralmente não é necessário um ajuste
posológico
em idosos (ver recomendações relativas à posologia em doentes com compromisso renal). Se for necessária
a
titulação para a dose máxima diária de 40 mg, a tensão arterial deve ser cuidadosamente monitorizada.
Compromisso
renal: A dose máxima em doentes com compromisso renal ligeiro a moderado (depuração da
creatinina 20-60
ml/min) é de 20 mg de olmesartan medoxomilo uma vez por dia, devido à experiência limitada com dosagens
mais
elevadas neste grupo de doentes. Não se recomenda a utilização de olmesartan medoxomilo em doentes com
compromisso renal grave (depuração da creatinina < 20 ml/min), dado que existe uma experiência limitada
com
este grupo de doentes.
Compromisso hepático: Não são necessários ajustes das doses recomendadas
em
doentes com compromisso hepático ligeiro. Em doentes com compromisso hepático moderado, a dose inicial
recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder os 20
mg
uma vez por dia. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em
doentes
com compromisso hepático que já estão em tratamento com diuréticos e/ou outros fármacos
anti-hipertensores.
Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático grave, pelo que não
se
recomenda a sua utilização neste grupo de doentes. Olmesartan medoxomilo não deve ser usado em doentes
com
obstrução biliar.
População pediátrica: Crianças e adolescentes dos 6 anos a menos de 18 anos de
idade: A dose inicial recomendada é de 10 mg uma vez por dia. Em crianças cuja pressão arterial não está
adequadamente controlada com esta dose, a dose de olmesartan medoxomilo pode ser aumentada para 20 mg
uma
vez por dia. Se for necessária uma redução adicional da pressão arterial, em crinaças com peso ≥ 35 kg,
a
dose pode ser aumentada para um máximo de 40 mg. Em crianças com peso ≥ 35 kg, a dose diária não deve
exceder os 20 mg. Outra população pediátrica: A segurança e eficácia de olmesartan medoxomilo em
crianças
com idade de 1 a 5 anos ainda não foram estabelecidas. Olmesartan medoxomilo não deve ser utilizado em
crianças com menos de 1 ano de idade devido a preocupações com a segurança e a falta de dados neste
grupo
etário. Não existem dados disponíveis.
Modo de administração: A fim de facilitar a adesão à
terapêutica, recomenda-se que os comprimidos de Olsar sejam tomados aproximadamente à mesma hora, todos
os
dias, com ou sem alimentos, por exemplo ao pequeno-almoço. O comprimido deve ser engolido com uma
quantidade
suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado.
Contraindicações:
Hipersensibilidade à substância ativa ou a qualquer um dos excipientes mencionados. Segundo e terceiro
trimestres de gravidez. Obstrução biliar. O uso concomitante de Olsar com medicamentos contendo
aliscireno é
contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73 m
2).
Efeitos indesejáveis: Resumo do perfil de segurança: As reações
adversas mais frequentemente notificadas durante o tratamento com Olsar são cefaleias (7,7%), sintomas
do
tipo gripal (4,0%) e tonturas (3,7%). Em estudos de monoterapia controlados com placebo, a única reação
adversa inequivocamente relacionada com o tratamento foi a ocorrência de tonturas (incidência de 2,5%
com o
olmesartan medoxomilo e de 0,9% com o placebo). A incidência foi também ligeiramente superior com
olmesartan
medoxomilo comparativamente com placebo para hipertrigliceridemia (2,0% versus 1,1%) e para
creatina-fosfoquinase aumentada (1,3% versus 0,7%). As reações
adversas do Olsar em ensaios clínicos, estudos de segurança pós-autorização e notificações espontâneas
estão
resumidas abaixo. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações
adversas:
muito frequentes (≥1/10); frequentes (≥1/100, <1/10); pouco frequentes (≥1/1.000, <1/100); raras
(≥1/10.000,
<1/1.000); muito raras (<1/10.000).
Doenças do sangue e do sistema linfático Trombocitopenia:
Pouco
frequente.
Doenças do sistema imunitário Reações anafiláticas: Pouco frequente.
Doenças do
metabolismo e da nutrição Hipertrigliceridemia: Frequente. Hiperuricemia: Frequente. Hipercaliemia:
Rara.
Doenças do sistema nervoso Tonturas: Frequente. Cefaleias: Frequente.
Afeções do ouvido
e do
labirinto Vertigens: Pouco frequente.
Cardiopatias Angina de peito: Pouco frequente.
Vasculopatias
Hipotensão: Rara.
Doenças respiratórias, torácicas e do mediastino Bronquite: Frequente.
Faringite:
Frequente. Tosse: Frequente. Rinite: Frequente.
Doenças gastrointestinais Gastroenterite:
Frequente.
Diarreia: Frequente. Dor abdominal: Frequente. Náuseas: Frequente. Dispepsia: Frequente. Vómitos: Pouco
frequente. Enteropatia semelhante a esprue: Muito rara. Afeções dos tecidos cutâneos e subcutâneos
Exantema:
Pouco frequente. Dermatite alérgica: Pouco frequente. Urticária: Pouco frequente. Erupção cutânea: Pouco
frequente. Prurido: Pouco frequente. Angiedema: Rara.
Afeções musculosqueléticas e dos tecidos
conjuntivos Artrite: Frequente. Dorsalgia: Frequente. Dor esquelética: Frequente. Mialgia: Pouco
frequente. Espasmos musculares: Rara.
Doenças renais e urinárias Hematúria: Frequente. Infeção do
trato urinário: Frequente. Insuficiência renal aguda: Rara. Insuficiência renal: Rara.
Perturbações
gerais e alterações no local de administração Dor: Frequente. Dor torácica: Frequente. Edema
periférico:
Frequente. Sintomas do tipo gripal: Frequente. Fadiga: Frequente. Edema facial: Pouco frequente.
Astenia:
Pouco frequente. Mal-estar: Pouco frequente. Letargia: Rara.
Exames complementares de diagnóstico
Aumento das enzimas hepáticas: Frequente. Aumento da ureia no sangue: Frequente. Aumento da
creatina-fosfoquinase no sangue: Frequente. Aumento da creatinina no sangue: Rara. Foram notificados
casos
singulares de rabdomiólise em associação temporal com a toma de bloqueadores dos recetores da
angiotensina
II.
Informação adicional em populações especiais: População pediátrica A segurança do olmesartan
medoxomilo foi monitorizada em 361 crianças e adolescentes, com idades entre 1-17 anos em 2 ensaios
clínicos. Embora a natureza e gravidade dos acontecimentos adversos sejam semelhantes às dos adultos, a
frequência dos seguintes acontecimentos adversos é mais elevada nas crianças: - A epistaxe é um
acontecimento adverso frequente em crianças (ou seja ≥ 1/100, <1/10) que não tem sido notificado em
adultos.
- Durante as 3 semanas do ensaio de dupla ocultação, a incidência de tonturas e de cefaleias emergentes
do
tratamento quase duplicou em crianças com 6-17 anos de idade no grupo de dose elevada de olmesartan
medoxomilo. O perfil de segurança global para o olmesartan medoxomilo em doentes pediátricos não difere
de
forma significativa do perfil de segurança em adultos. Idosos (idade igual ou superior a 65 anos), a
frequência de hipotensão aumenta ligeiramente, de rara para pouco frequente. Pede-se aos profissionais
de
saúde que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. (tel: +351 21
798
73 73; Linha do medicamento: 800222444 (gratuita); Fax: +351 21 798 73 97; E-mail:
farmacovigilancia@infarmed.pt; internet:
http://extranet.infarmed.pt/page.seram.frontoffice.seramhomepage.
Para mais informações deverá contactar o titular da autorização de introdução no mercado -
Menarini
International Operations Luxembourg S.A.. Representante: A. Menarini Portugal-Farmacêutica, S.A.
Informações
revistas em Março de 2022. Para mais informações deverá contactar o representante local do Titular da
Autorização de Introdução no Mercado: A. Menarini Portugal – Farmacêutica, S.A. Medicamento sujeito a
receita médica. Medicamento Comparticipado - Escalão B. Ref ª 06/2022
OLSAR PLUS
PLUS Informações essenciais compatíveis com o RCM
NOME DO MEDICAMENTO:
Olsar Plus 20 mg/12,5 mg, comprimidos revestidos por
película. Olsar Plus 20 mg/25 mg, comprimidos revestidos por película.
COMPOSIÇÃO QUALITATIVA E QUANTITATIVA:
Olsar Plus 20 mg/12,5 mg
comprimidos
revestidos por película: Cada comprimido revestido por película contém 20 mg de olmesartan medoxomilo e
12,5
mg de hidroclorotiazida. Olsar Plus 20 mg/25 mg comprimidos revestidos por película: Cada comprimido
revestido por película contém 20 mg de olmesartan medoxomilo e 25 mg de hidroclorotiazida. Excipientes
com
efeito conhecido: Olsar Plus 20 mg/12,5 mg comprimidos revestidos por película: cada comprimido
revestido
por película contém 110,7 mg de lactose mono-hidratada. Olsar Plus 20 mg/25 mg comprimidos revestidos
por
película: cada comprimido revestido por película contém 98,2 mg de lactose mono-hidratada.
FORMA FARMACÊUTICA:
Comprimidos revestidos por película. Olsar Plus 20
mg/12,5
mg comprimidos revestidos por película: comprimidos revestidos por película de cor alaranjada, forma
redonda, de 8,5 mm com C22 gravado num dos lados. Olsar Plus 20 mg/25 mg comprimidos revestidos por
película: comprimidos revestidos por película de cor rosada, forma redonda, de 8,5 mm com C24 gravado
num
dos lados.
INFORMAÇÕES CLÍNICAS:
Indicações terapêuticas: Tratamento da
hipertensão essencial. A combinação de dose fixa de Olsar Plus está indicada em doentes adultos cuja
tensão
arterial não está adequadamente controlada com olmesartan medoxomilo em monoterapia.
Posologia e modo de administração: Posologia:
Adultos O Olsar Plus
não
deve ser utilizado como terapêutica inicial, mas em doentes cuja tensão arterial não esteja
adequadamente
controlada com 20 mg de olmesartan medoxomilo em monoterapia. Olsar Plus é administrado uma vez por dia,
com
ou sem alimentos. Quando clinicamente apropriado, pode ser considerada uma mudança direta da monoterapia
com
20 mg de olmesartan medoxomilo para a combinação fixa, tendo em atenção que o efeito anti-hipertensor do
olmesartan medoxomilo atinge o seu máximo cerca de 8 semanas após o início do tratamento. Recomenda-se a
titulação da dose dos componentes individuais: Olmesartan medoxomilo 20 mg/hidroclorotiazida 12,5 mg
pode
ser administrado em doentes cuja tensão arterial não esteja adequadamente controlada pela monoterapia
otimizada com olmesartan medoxomilo 20 mg. Olmesartan medoxomilo 20 mg/hidroclorotiazida 25 mg pode ser
administrado em doentes cuja tensão arterial não esteja adequadamente controlada com olmesartan
medoxomilo
20 mg/hidroclorotiazida 12,5 mg.
Idosos (idade igual ou superior a 65 anos) Em idosos a dosagem recomendada da combinação é
idêntica à
usada nos adultos.
Compromisso renal Quando o Olsar Plus é utilizado em doentes com compromisso renal ligeiro a
moderado
(depuração da creatinina 30 – 60 ml/min.), recomenda-se a monitorização periódica da função renal. O
Olsar
Plus está contraindicado em doentes com compromisso renal grave (depuração da creatinina < 30 ml/min.).
Compromisso hepático Olsar Plus deve ser usado com precaução em doentes com compromisso hepático
ligeiro a moderado. Em doentes com compromisso hepático moderado, a dose inicial recomendada de
olmesartan
medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder 20 mg uma vez por dia. É
aconselhável
uma monitorização cuidadosa da tensão arterial e da função renal em doentes com compromisso hepático que
estão em tratamento com diuréticos e/ou outros fármacos anti-hipertensores. Não existe experiência com
olmesartan medoxomilo em doentes com compromisso hepático grave. Olsar Plus não deve ser usado em
doentes
com compromisso hepático grave, colestase e obstrução biliar.
População pediátrica A segurança e eficácia de Olsar Plus em crianças e adolescentes com idade
inferior a 18 anos não foram ainda estabelecidas. Não existem dados disponíveis.
Modo de administração: O comprimido deve ser engolido com uma quantidade suficiente de líquido
(por
exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser tomado à mesma hora todos os
dias.
Contraindicações: Hipersensibilidade às substâncias ativas, a qualquer um dos excipientes ou a
outras
substâncias derivadas da sulfonamida (dado que a hidroclorotiazida é um fármaco derivado da
sulfonamida).
Compromisso renal grave (depuração da creatinina < 30 ml/min). Hipocaliemia refractária, hipercalcemia,
hiponatremia e hiperuricemia sintomática. Compromisso hepático grave, colestase e afeções biliares
obstrutivas. Segundo e terceiro trimestres de gravidez. O uso concomitante de Olsar Plus com
medicamentos
contendo aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60
ml/min./1,73 m
2).
Efeitos indesejáveis: As reações adversas mais frequentemente notificadas durante o tratamento
com
Olsar Plus são cefaleias (2,9%), tonturas (1,9%) e fadiga (1,0%). A hidroclorotiazida pode causar ou
exacerbar uma depleção de volume que pode levar a desequilíbrio eletrolítico. Em ensaios clínicos
envolvendo
1155 doentes tratados com combinações de olmesartan medoxomilo e hidroclorotiazida nas dosagens de 20
mg/12,5 mg ou 20 mg/25 mg e 466 doentes tratados com placebo durante períodos até 21 meses, a frequência
global de reações adversas na terapêutica combinada de olmesartan medoxomilo e hidroclorotiazida foi
similar
à terapêutica com placebo. As interrupções devidas a reações adversas foram também similares para
olmesartan
medoxomilo/hidroclorotiazida 20 mg/12,5 mg – 20 mg/25 mg (2%) e placebo (3%). A frequência global de
reações
adversas com olmesartan medoxomilo/hidroclorotiazida relativamente ao placebo aparentou não estar
relacionada com a idade (< 65 anos versus ≥ 65 anos), sexo ou raça, embora a frequência de tonturas
tenha
sido ligeiramente superior em doentes com idade ≥ a 75 anos. Adicionalmente, a segurança de Olsar Plus
como
combinação de dose elevada foi estudada em ensaios clínicos realizados em 3709 doentes que receberam
olmesartan medoxomilo em combinação com hidroclorotiazida nas dosagens de 40 mg/12,5 mg e 40 mg/25 mg.
As
reações adversas do Olsar Plus em ensaios clínicos, estudos de segurança pós-autorização e notificações
espontâneas estão resumidas na tabela em baixo, bem como as reações adversas dos componentes
individuais,
olmesartan medoxomilo e hidroclorotiazida, baseadas no perfil de segurança conhecido destas substâncias.
Foi
utilizada a seguinte terminologia para classificar a ocorrência das reações adversas de todas as
dosagens da
combinação de dose fixa de olmesartan medoxomilo e hidroclorotiazida: muito frequente (≥1/10); frequente
(≥1/100 a <1/10); pouco frequente (≥1/1.000 a <1/100); rara (≥1/10.000 a <1/1.000); muito rara
(<1/10.000),
desconhecido (não pode ser calculado a partir dos dados disponíveis).
Infeções e infestações:
Sialadenite: rara (HCTZ).
Neoplasias benignas, malignas e não especificadas (incluindo quistos e
pólipos): Cancro da pele não melanoma (carcinoma basocelular e carcinoma espinocelular):
desconhecido
(HCTZ). Doenças do sangue e do sistema linfático: Anemia aplástica: rara (HCTZ). Depressão da
medula
óssea: rara (HCTZ). Anemia hemolítica: rara (HCTZ). Leucopenia: rara (HCTZ). Neutropenia /
Agranulocitose:
rara (HCTZ). Trombocitopenia: pouco frequente (Olmesartan); rara (HCTZ).
Doenças do sistema
imunitário: Reações anafiláticas: pouco frequente (Olmesartan, HCTZ).
Doenças do metabolismo e da
nutrição: Anorexia: pouco frequente (HCTZ). Glicosúria: frequente (HCTZ). Hipercalcemia: frequente
(HCTZ). Hipercolesterolemia: pouco frequente (Olsar Plus); muito frequente (HCTZ). Hiperglicemia:
frequente
(HCTZ). Hipercaliemia: rara (Olmesartan). Hipertrigliceridemia: pouco frequente (Olsar Plus); frequente
(Olmesartan); muito frequente (HCTZ). Hiperuricemia: pouco frequente (Olsar Plus); frequente
(Olmesartan);
muito frequente (HCTZ). Hipocloremia: frequente (HCTZ). Alcalose hipoclorémica: muito rara (HCTZ).
Hipocaliemia: frequente (HCTZ). Hipomagnesemia: frequente (HCTZ). Hiponatremia: frequente (HCTZ).
Hiperamilasemia: frequente (HCTZ).
Perturbações do foro psiquiátrico: Apatia: rara (HCTZ).
Depressão:
rara (HCTZ). Agitação: rara (HCTZ). Perturbações do sono: rara (HCTZ).
Doenças do sistema
nervoso:
Estado confuso: frequente (HCTZ). Convulsões: rara (HCTZ). Perturbações de consciência (tais como perda
de
consciência): rara (Olsar Plus). Tonturas / Sensação de cabeça leve: frequente (Olsar Plus, Olmesartan,
HCTZ). Cefaleias: frequente (Olsar Plus, Olmesartan); rara (HCTZ). Perda de apetite: pouco frequente
(HCTZ).
Parestesia: rara (HCTZ). Tonturas posturais: pouco frequente (Olsar Plus). Sonolência: pouco frequente
(Olsar Plus). Síncope: pouco frequente (Olsar Plus).
Afeções oculares: Diminuição da formação do
líquido lacrimal: rara (HCTZ). Visão turva transitória: rara (HCTZ). Agravamento da miopia
pré-existente:
pouco frequente (HCTZ). Miopia aguda, glaucoma agudo de ângulo fechado: Desconhecido (HCTZ). Efusão
coroidal: Desconhecido (HCTZ). Xantopsia: rara (HCTZ).
Afeções do ouvido e do labirinto:
Vertigens:
pouco frequente (Olsar Plus, Olmesartan); rara (HCTZ).
Cardiopatias: Angina de peito: pouco
frequente
(Olmesartan). Arritmias cardíacas: rara (HCTZ). Palpitações: pouco frequente (Olsar Plus).
Vasculopatias: Embolia: rara (HCTZ). Hipotensão: pouco frequente (Olsar Plus); rara (Olmesartan).
Angeíte necrótica (vasculite, vasculite cutânea): rara (HCTZ). Hipotensão ortostática: pouco frequente
(Olsar Plus, HCTZ). Trombose: rara (HCTZ).
Doenças respiratórias, torácicas e do mediastino:
Bronquite: frequente(Olmesartan). Tosse: pouco frequente (Olsar Plus); frequente (Olmesartan). Dispneia:
rara (HCTZ). Pneumonia intersticial: rara (HCTZ). Faringite: frequente (Olmesartan). Edema pulmonar:
rara
(HCTZ). Dificuldade respiratória: pouco frequente (HCTZ). Rinite: frequente (Olmesartan).
Doenças
gastrointestinais: Dor abdominal: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ).
Obstipação: frequente (HCTZ). Diarreia: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ).
Dispepsia: pouco frequente (Olsar Plus); frequente (Olmesartan). Irritação gástrica: frequente (HCTZ).
Gastroenterite: frequente (Olmesartan). Meteorismo: frequente (HCTZ). Náuseas: pouco frequente (Olsar
Plus);
frequente (Olmesartan, HCTZ). Pancreatite: rara (HCTZ). Ileus paralítico: muito rara (HCTZ). Vómitos:
pouco
frequente (Olsar Plus, Olmesartan); frequente (HCTZ). Enteropatia semelhante a esprue: Muito rara
(Olmesartan).
Afeções hepatobiliares: Colecistite aguda: rara (HCTZ). Icterícia (icterícia
intra-hepática colestática): rara (HCTZ).
Afeções dos tecidos cutâneos e subcutâneos: Dermatite
alérgica: pouco frequente (Olmesartan). Reações anafiláticas cutâneas: rara (HCTZ). Edema
angioneurótico:
rara (Olsar Plus, Olmesartan). Reações do tipo lúpus eritematoso cutâneo: rara (HCTZ). Eczema: pouco
frequente (Olsar Plus). Eritema: pouco frequente (HCTZ). Exantema: pouco frequente (Olmesartan). Reações
de
fotossensibilidade: pouco frequente (HCTZ). Prurido: pouco frequente (Olmesartan, HCTZ). Púrpura: pouco
frequente (HCTZ). Erupção cutânea: pouco frequente (Olsar Plus, Olmesartan, HCTZ). Reativação de lúpus
eritematoso cutâneo: rara (HCTZ). Necrólise epidérmica tóxica: rara (HCTZ). Urticária: rara (Olsar
Plus);
pouco frequente (Olmesartan, HCTZ).
Afeções musculosqueléticas e dos tecidos conjuntivos:
Artralgia:
pouco frequente (Olsar Plus). Artrite: frequente (Olmesartan). Dorsalgia: pouco frequente (Olsar Plus);
frequente (Olmesartan). Espasmos musculares: pouco frequente (Olsar Plus); rara (Olmesartan). Fraqueza
muscular: rara (HCTZ). Mialgia: pouco frequente (Olsar Plus, Olmesartan). Dores nas extremidades: pouco
frequente (Olsar Plus). Paresia: rara (HCTZ). Dor esquelética: frequente (Olmesartan).
Doenças renais
e
urinárias: Insuficiência renal aguda: rara (Olsar Plus, Olmesartan). Hematúria: pouco frequente
(Olsar
Plus); frequente (Olmesartan). Nefrite intersticial: rara (HCTZ). Insuficiência renal: rara
(Olmesartan).
Disfunção renal: rara (HCTZ). Infeção do trato urinário: frequente (Olmesartan).
Doenças dos órgãos
genitais e da mama: Disfunção eréctil: Pouco frequente (Olsar Plus, HCTZ).
Perturbações gerais e
alterações no local de administração: Astenia: frequente (Olsar Plus); pouco frequente (Olmesartan).
Dor no peito: frequente (Olsar Plus, Olmesartan). Edema facial: pouco frequente (Olmesartan). Fadiga:
frequente (Olsar Plus, Olmesartan). Febre: rara (HCTZ). Sintomas do tipo gripal: frequente (Olmesartan).
Letargia: rara (Olmesartan). Mal-estar: rara (Olsar Plus); pouco frequente (Olmesartan). Dor: frequente
(Olmesartan). Edema periférico: Frequente (Olsar Plus, Olmesartan). Fraqueza: pouco frequente (Olsar
Plus).
Exames complementares de diagnóstico: Aumento da alanina aminotransferase: pouco frequente
(Olsar Plus). Aumento da aspartato aminotransferase: pouco frequente (Olsar Plus). Aumento do cálcio no
sangue: pouco frequente (Olsar Plus). Aumento da creatinina no sangue: pouco frequente (Olsar Plus);
rara (Olmesartan), frequente (HCTZ). Aumento da creatina fosfoquinase no sangue: frequente (Olmesartan).
Aumento da glucose no sangue: pouco frequente (Olsar Plus). Diminuição do hematócrito sanguíneo: rara
(Olsar Plus). Diminuição da hemoglobina sanguínea: rara (Olsar Plus). Aumento dos lípidos no sangue:
pouco frequente (Olsar Plus). Diminuição do potássio no sangue: pouco frequente (Olsar Plus). Aumento do
potássio no sangue: pouco frequente (Olsar Plus). Aumento da ureia no sangue: pouco frequente (Olsar
Plus); frequente (Olmesartan, HCTZ). Aumento do azoto ureico sanguíneo: rara (Olsar Plus). Aumento do
ácido úrico sanguíneo: rara (Olsar Plus). Aumento da gama glutamil transferase: pouco frequente (Olsar
Plus). Aumento das enzimas hepáticas: frequente (Olmesartan). Foram notificados casos isolados de
rabdomiólise em associação temporal com a administração de bloqueadores dos recetores da angiotensina
II. Cancro da pele não-melanoma: Com base nos dados disponíveis de estudos epidemiológicos observou-se
uma associação entre a HCTZ e o NMSC, dependente da dose cumulativa. Pede-se aos profissionais de saúde
que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. Sítio da internet:
http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente) ou através dos seguintes contactos
Direção de Gestão do Risco de Medicamentos Parque da Saúde de Lisboa, Av. Brasil 53 1749-004 Lisboa;
Tel: +351 21 798 73 73; Linha do medicamento: 800222444 (gratuita); E-mail:
farmacovigilancia@infarmed.pt). Informações revistas em Março de 2022. Para mais informações deverá
contactar o representante local do Titular da Autorização de Introdução no Mercado: A. Menarini Portugal
– Farmacêutica, S.A., Quinta da Fonte, Edifício D. Manuel I, Piso 2 - A, Rua dos Malhões nº. 1, 2770-071
Paço de Arcos, Portugal. Medicamento sujeito a receita médica. Medicamento Comparticipado – Escalão B
(Regime Geral 69%). Ref ª 10/2022
Informações essenciais compatíveis com o RCM
NOME DO MEDICAMENTO:
Olsar Plus 40 mg + 12,5 mg, comprimidos revestidos
por película. Olsar
Plus 40 mg + 25 mg,
comprimidos revestidos por película.
COMPOSIÇÃO QUALITATIVA E
QUANTITATIVA:
Olsar Plus 40 mg + 12,5 mg, comprimidos revestidos por
película: Cada
comprimido
revestido por película contém 40 mg de olmesartan medoxomilo e 12,5 mg de hidroclorotiazida. Olsar
Plus 40 mg + 25 mg, comprimidos revestidos por película: Cada comprimido revestido por película
contém 40 mg de olmesartan medoxomilo e 25 mg de hidroclorotiazida. Excipientes com efeito conhecido:
Olsar Plus 40 mg + 12,5 mg, comprimidos revestidos por película: cada comprimido revestido por
película contém 233,9 mg de lactose mono-hidratada. Olsar Plus 40 mg + 25 mg, comprimidos revestidos
por película: cada comprimido revestido por película contém 221,4 mg de lactose mono-hidratada.
FORMA FARMACÊUTICA:
Comprimidos revestidos por película. Olsar
Plus 40
mg + 12,5 mg:
comprimidos revestidos por película: comprimidos revestidos por película de cor alaranjada, forma oval,
de 15 x 7 mm com C23 gravado num dos lados. Olsar Plus 40 mg + 25 mg: comprimidos revestidos por
película: comprimidos revestidos por película de cor rosada, forma oval, de 15 x 7 mm com C25 gravado
num dos lados.
INFORMAÇÕES CLÍNICAS:
Indicações
terapêuticas: Tratamento
da hipertensão essencial. As
combinações de dose fixa de Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg estão indicadas em doentes
adultos cuja tensão arterial não está adequadamente controlada com 40 mg de olmesartan medoxomilo em
monoterapia.
Posologia e modo de administração: Posologia
Adultos A
dose
recomendada de Olsar Plus 40 mg
+ 12,5 mg ou 40 mg + 25 mg é de um comprimido por dia. O Olsar Plus 40 mg + 12,5 mg pode ser utilizado
em doentes cuja tensão arterial não esteja adequadamente controlada com 40 mg de olmesartan medoxomilo
em monoterapia. O Olsar Plus 40 mg + 25 mg pode ser utilizado em doentes cuja tensão arterial não esteja
adequadamente controlada com a combinação de dose fixa de Olsar Plus 40 mg + 12,5 mg. Por conveniência,
os doentes a tomar olmesartan medoxomilo e hidroclorotiazida em comprimidos separados podem mudar para
Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg comprimidos contendo os componentes nas mesmas doses. O Olsar
Plus 40 mg + 12,5 mg e 40 mg + 25 mg pode ser tomado com ou sem alimentos.
Idosos (idade igual ou
superior a 65 anos) Em idosos a dosagem
recomendada da combinação é idêntica à usada nos adultos. A
tensão arterial deve ser monitorizada cuidadosamente.
Compromisso renal O Olsar Plus está
contraindicado
em doentes com compromisso renal grave (depuração da creatinina < 30 ml/min). A dose máxima de
olmesartan medoxomilo em doentes com compromisso renal ligeiro a moderado (depuração da creatinina de
30-60 ml/min) é de 20 mg de olmesartan medoxomilo uma vez por dia, devido à experiência limitada com
doses mais elevadas neste grupo de doentes, sendo recomendada uma monitorização periódica. Olsar Plus 40
mg + 12,5 mg e 40 mg + 25 mg está assim contraindicado em todos os graus de compromisso renal.
Compromisso hepático O Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg deve ser usado com precaução em
doentes com compromisso hepático ligeiro. É aconselhável uma monitorização cuidadosa da tensão arterial
e da função renal em doentes com compromisso hepático que estão em tratamento com diuréticos e/ou outros
fármacos anti-hipertensores. Em doentes com compromisso hepático moderado, a dose inicial recomendada de
olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder os 20 mg uma vez por
dia. Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático grave. Olsar
Plus 40 mg + 12,5 mg e 40 mg + 25 mg não deve ser usado em doentes com compromisso hepático moderado e
grave, colestase e obstrução biliar.
População pediátrica A segurança e eficácia de Olsar Plus 40 mg +
12,5 mg e 40 mg + 25 mg em crianças e adolescentes com idade inferior a 18 anos não foram ainda
estabelecidas. Não existem dados disponíveis.
Modo de administração:
O
comprimido deve ser engolido com
uma quantidade suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado
e deve ser tomado à mesma hora todos os dias.
Contraindicações:
Hipersensibilidade às substâncias
ativas, a qualquer um dos excipientes ou a outras substâncias derivadas da sulfonamida (dado que a
hidroclorotiazida é um fármaco derivado da sulfonamida). Compromisso renal. Hipocaliemia refractária,
hipercalcemia, hiponatremia e hiperuricemia sintomática. Compromisso hepático moderado e grave,
colestase e afeções biliares obstrutivas. Segundo e terceiro trimestres de gravidez. O uso concomitante
de Olsar Plus com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou
compromisso renal (TFG < 60 ml/min./1,73 m2).
Efeitos indesejáveis:
As
reações adversas mais
frequentemente notificadas durante o tratamento com Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg são
cefaleias (2,9%), tonturas (1,9%) e fadiga (1,0%). A hidroclorotiazida pode causar ou exacerbar uma
depleção de volume que pode levar a desequilíbrio eletrolítico. A segurança do Olsar Plus 40 mg + 12,5
mg e 40 mg + 25 mg foi estudada em ensaios clínicos envolvendo 3709 doentes tratados com olmesartan
medoxomilo em combinação com hidroclorotiazida. Outras reações adversas relatadas com a combinação de
dose fixa de olmesartan medoxomilo e hidroclorotiazida nas doses mais baixas de 20 mg + 12,5 mg e 20 mg
+ 25 mg podem ser potenciais reações adversas de Olsar Plus 40 mg + 12,5 mg e 40 mg + 25 mg. As reações
adversas do Olsar Plus em ensaios clínicos, estudos de segurança pós-autorização e notificações
espontâneas estão resumidas na tabela em baixo, bem como as reações adversas dos componentes
individuais, olmesartan medoxomilo e hidroclorotiazida, baseadas no perfil de segurança conhecido destas
substâncias. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações adversas:
muito frequente (≥1/10); frequente (≥1/100 a <1/10); pouco frequente (≥1/1.000 a <1/100); rara
(>1/10.000 a <1/1.000); muito rara (<1/10.000), desconhecido (não pode ser calculado a partir dos dados
disponíveis). Infeções e infestações Sialadenite: rara (HCTZ).
Neoplasias benignas, malignas e não
especificadas (incluindo quistos e pólipos): Cancro da pele não melanoma
(carcinoma basocelular e
carcinoma espinocelular): desconhecido (HCTZ).
Doenças do sangue e do sistema linfático Anemia
aplástica: rara (HCTZ). Depressão da medula óssea: rara (HCTZ). Anemia hemolítica: rara (HCTZ).
Leucopenia: rara (HCTZ). Neutropenia / Agranulocitose: rara (HCTZ). Trombocitopenia: pouco frequente
(Olmesartan); rara (HCTZ).
Doenças do sistema imunitário Reações anafiláticas: pouco frequente
(Olmesartan, HCTZ).
Doenças do metabolismo e da nutrição Anorexia: pouco frequente (HCTZ). Glicosúria:
frequente (HCTZ). Hipercalcemia: frequente (HCTZ). Hipercolesterolemia: pouco frequente (Olsar Plus);
muito frequente (HCTZ). Hiperglicemia: frequente (HCTZ). Hipercaliemia: rara (Olmesartan).
Hipertrigliceridemia: pouco frequente (Olsar Plus); frequente (Olmesartan); muito frequente (HCTZ).
Hiperuricemia: pouco frequente (Olsar Plus); frequente (Olmesartan); muito frequente (HCTZ).
Hipocloremia: frequente (HCTZ). Alcalose hipoclorémica: muito rara (HCTZ). Hipocaliemia: frequente
(HCTZ). Hipomagnesemia: frequente (HCTZ). Hiponatremia: frequente (HCTZ). Hiperamilasemia: frequente
(HCTZ).
Perturbações do foro psiquiátrico Apatia: rara (HCTZ). Depressão: rara (HCTZ). Agitação: rara
(HCTZ). Perturbações do sono: rara (HCTZ).
Doenças do sistema nervoso Estado confuso: frequente (HCTZ).
Convulsões: rara (HCTZ). Perturbações de consciência (tais como perda de consciência): rara (Olsar
Plus). Tonturas/Sensação de cabeça leve: frequente (Olsar Plus, Olmesartan, HCTZ). Cefaleias: frequente
(Olsar Plus, Olmesartan); rara (HCTZ). Perda de apetite: pouco frequente (HCTZ). Parestesia: rara
(HCTZ). Tonturas posturais: pouco frequente (Olsar Plus). Sonolência: pouco frequente (Olsar Plus).
Síncope: pouco frequente (Olsar Plus).
Afeções oculares Diminuição da formação do líquido lacrimal: rara (HCTZ). Visão turva transitória: rara (HCTZ). Agravamento da miopia pré-existente: pouco frequente (HCTZ). Miopia aguda, glaucoma agudo do ângulo fechado: Desconhecido (HCTZ). Efusão coroidal: Desconhecido (HCTZ). Xantopsia: rara (HCTZ).
Afeções do ouvido e do labirinto Vertigens: pouco frequente
(Olsar Plus, Olmesartan); rara (HCTZ).
Cardiopatias Angina de peito: pouco frequente (Olmesartan).
Arritmias cardíacas: rara (HCTZ). Palpitações: pouco frequente (Olsar Plus). Vasculopatias Embolismo:
rara (HCTZ). Hipotensão: pouco frequente (Olsar Plus); rara (Olmesartan). Angeíte necrótica (vasculite,
vasculite cutânea): rara (HCTZ). Hipotensão ortostática: pouco frequente (Olsar Plus); pouco frequente
(HCTZ). Trombose: rara (HCTZ).
Doenças respiratórias, torácicas e do mediastino Bronquite: frequente
(Olmesartan). Tosse: pouco frequente (Olsar Plus); frequente (Olmesartan). Dispneia: rara (HCTZ).
Pneumonia intersticial: rara (HCTZ). Faringite: frequente (Olmesartan). Edema pulmonar: rara (HCTZ).
Dificuldade respiratória: pouco frequente (HCTZ). Rinite: frequente (Olmesartan). Síndrome da
insuficiência respiratória aguda (ARDS): muito rara (HCTZ).
Doenças gastrointestinais Dor abdominal:
pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Obstipação: frequente (HCTZ). Diarreia:
pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ). Dispepsia: pouco frequente (Olsar Plus);
frequente (Olmesartan). Irritação gástrica: frequente (HCTZ). Gastroenterite: frequente (Olmesartan).
Meteorismo: frequente (HCTZ). Náuseas: pouco frequente (Olsar Plus); frequente (Olmesartan, HCTZ).
Pancreatite: rara (HCTZ). Ileus paralítico: muito rara (HCTZ). Vómitos: pouco frequente (Olsar Plus,
Olmesartan); frequente (HCTZ). Enteropatia semelhante a esprue: Muito rara (Olmesartan).
Afeções
hepatobiliares
Colecistite aguda: rara (HCTZ). Icterícia (icterícia intra-hepática colestática): rara
(HCTZ) Hepatite auto-imune: desconhecido (olmesartan) (na experiência pós-comercialização foram
reportados casos de hepatite autoimune, com período de latência de alguns meses a anos, que foram
reversíveis após a descontinuação da terapêutica com olmesartan).
Afeções dos tecidos cutâneos e
subcutâneos Dermatite alérgica: pouco
frequente (Olmesartan). Reações anafiláticas cutâneas: rara
(HCTZ). Edema angioneurótico: rara (Olsar Plus, Olmesartan). Reações do tipo lúpus eritematoso cutâneo:
rara (HCTZ). Eczema: pouco frequente (Olsar Plus). Eritema: pouco frequente (HCTZ). Exantema: pouco
frequente (Olmesartan). Reações de fotossensibilidade: pouco frequente (HCTZ). Prurido: pouco frequente
(Olmesartan, HCTZ). Púrpura: pouco frequente (HCTZ). Erupção cutânea: pouco frequente (Olsar Plus,
Olmesartan, HCTZ). Reativação de lúpus eritematoso cutâneo: rara (HCTZ). Necrólise epidérmica tóxica:
rara (HCTZ). Urticária: rara (Olsar Plus); pouco frequente (Olmesartan, HCTZ).
Afeções
musculosqueléticas e dos tecidos conjuntivos Artralgia: pouco
frequente (Olsar Plus). Artrite: frequente
(Olmesartan). Dorsalgia: pouco frequente (Olsar Plus); frequente (Olmesartan). Espasmos musculares:
Pouco frequente (Olsar Plus); rara (Olmesartan). Fraqueza muscular: rara (HCTZ). Mialgia: pouco
frequente (Olsar Plus, Olmesartan). Dores nas extremidades: pouco frequente (Olsar Plus). Paresia: rara
(HCTZ). Dor esquelética: frequente (Olmesartan).
Doenças renais e urinárias Insuficiência renal aguda:
rara (Olsar Plus, Olmesartan). Hematúria: pouco frequente (Olsar Plus); frequente (Olmesartan). Nefrite
intersticial: rara (HCTZ). Insuficiência renal: rara (Olmesartan). Disfunção renal: rara (HCTZ). Infeção
do trato urinário: frequente (Olmesartan).
Doenças dos órgãos genitais e da mama Disfunção eréctil:
pouco frequente (Olsar Plus, HCTZ).
Perturbações gerais e alterações no local de administração Astenia: frequente (Olsar Plus); pouco frequente (Olmesartan). Dor no peito: frequente (Olsar Plus, Olmesartan). Edema facial: pouco frequente (Olmesartan). Fadiga: frequente (Olsar Plus, Olmesartan). Febre: rara (HCTZ). Sintomas do tipo gripal: frequente (Olmesartan). Letargia: rara (Olmesartan). Mal-estar: rara (Olsar Plus); pouco frequente (Olmesartan). Dor: frequente (Olmesartan). Edema periférico: frequente (Olsar Plus, Olmesartan). Fraqueza: pouco frequente (Olsar Plus).
Exames complementares de diagnóstico
Aumento da alanina aminotransferase: pouco frequente (Olsar Plus). Aumento da aspartato
aminotransferase: pouco frequente (Olsar Plus). Aumento do cálcio no sangue: pouco frequente (Olsar
Plus). Aumento da creatinina no sangue: pouco frequente (Olsar Plus); rara (Olmesartan); frequente
(HCTZ). Aumento da creatina fosfoquinase no sangue: frequente (Olmesartan). Aumento da glucose no
sangue: pouco frequente (Olsar Plus). Diminuição do hematócrito sanguíneo: rara (Olsar Plus). Diminuição
da hemoglobina sanguínea: rara (Olsar Plus). Aumento dos lípidos no sangue: pouco frequente (Olsar
Plus). Diminuição do potássio no sangue: pouco frequente (Olsar Plus). Aumento do potássio no sangue:
pouco frequente (Olsar Plus). Aumento da ureia no sangue: pouco frequente (Olsar Plus); frequente
(Olmesartan, HCTZ). Aumento do azoto ureico sanguíneo: rara (Olsar Plus). Aumento do ácido úrico
sanguíneo: rara (Olsar Plus). Aumento da gama glutamil transferase: pouco frequente (Olsar Plus).
Aumento das enzimas hepáticas: frequente (Olmesartan). Foram notificados casos singulares de
rabdomiólise em associação temporal com a toma de bloqueadores dos recetores da angiotensina II. Cancro
da pele não-melanoma: Com base nos dados disponíveis de estudos epidemiológicos observou-se uma
associação entre a HCTZ e o NMSC, dependente da dose cumulativa. Pede-se aos profissionais de saúde que
notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. Sítio da internet:
http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente) ou através dos seguintes contactos
Direção de Gestão do Risco de Medicamentos Parque da Saúde de Lisboa, Av. Brasil 53 1749-004 Lisboa;
Tel: +351 21 798 73 73; Linha do medicamento: 800222444 (gratuita); E-mail:
farmacovigilancia@infarmed.pt). Informações revistas em Março de 2022. Para mais informações deverá
contactar o representante local do Titular da Autorização de Introdução no Mercado: A. Menarini Portugal
– Farmacêutica, S.A., Quinta da Fonte, Edifício D. Manuel I, Piso 2 - A, Rua dos Malhões nº. 1, 2770-071
Paço de Arcos, Portugal. Medicamento sujeito a receita médica. Medicamento Comparticipado – Escalão B
(Regime Geral 69%). Ref ª 08/2022
ZOLNOR
Informações Essenciais Compatíveis como Resumo das Características do
Medicamento
Zolnor 2 0 mg + 5 mg comprimidos revestidos por
película. Cada comprimido revestido por película de Zolnor contém 20 mg de olmesartan medoxomilo e 5 mg
de amlodipina (como besilato de amlodipina). Comprimido revestido por película. Cor branca, forma
redonda, comprimido revestido por película de 6 mm com C73 gravado num dos lados.
INFORMAÇÕES CLÍNICAS Indicações terapêuticas:
Tratamento da hipertensão
essencial. Zolnor está indicado em doentes adultos cuja tensão arterial não está adequadamente
controlada com olmesartan medoxomilo ou amlodipina em monoterapia.
POSOLOGIA: Adultos:
A posologia recomendada de Zolnor é de um comprimido
por dia. Zolnor 20 mg + 5 mg pode ser administrado em doentes cuja tensão arterial não esteja
adequadamente controlada com olmesartan medoxomilo 20 mg ou amlodipina 5 mg em monoterapia. Recomenda-se
a titulação gradual da dosagem dos componentes individuais antes da mudança para a combinação fixa.
Quando clinicamente apropriado, pode ser considerada uma mudança direta da monoterapia para a combinação
fixa. Por conveniência, os doentes a tomar olmesartan medoxomilo e amlodipina em comprimidos separados
podem mudar para Zolnor comprimidos contendo os componentes nas mesmas doses. Zolnor pode ser tomado com
ou sem alimentos.
Idosos (idade igual ou superior a 65 anos):
Geralmente não é necessário um
ajuste da dose recomendada em idosos mas aumentos da dosagem devem ser efetuados com precaução. Se for
necessária a titulação para a dose máxima diária de 40 mg de olmesartan medoxomilo, a tensão arterial
deve ser cuidadosamente monitorizada.
Compromisso renal:
A dose máxima de olmesartan medoxomilo em doentes com
compromisso renal ligeiro a moderado (depuração da creatinina 20-60 ml/min) é de 20 mg de olmesartan
medoxomilo uma vez por dia, devido à experiência limitada com dosagens mais elevadas neste grupo de
doentes. Não se recomenda a utilização de Zolnor em doentes com compromisso renal grave (depuração da
creatinina <20 ml/min). É aconselhável a monitorização dos níveis de potássio e de creatinina em doentes
com compromisso renal moderado.
Compromisso hepático:
Zolnor deve ser usado com precaução em doentes com
compromisso hepático ligeiro a moderado. Em doentes com compromisso hepático moderado, a dose inicial
recomendada de olmesartan medoxomilo é de 10 mg uma vez por dia e a dose máxima não deve exceder os 20
mg uma vez por dia. É aconselhável uma monitorização cuidadosa da tensão arterial e da função renal em
doentes com compromisso hepático que já estão em tratamento com diuréticos e/ou outros fármacos
anti-hipertensores. Não existe experiência com olmesartan medoxomilo em doentes com compromisso hepático
grave. Como acontece com todos os antagonistas dos canais de cálcio, a semivida da amlodipina é
prolongada em doentes com compromisso hepático, não tendo sido estabelecidas recomendações relativas à
posologia. Nestes doentes, Zolnor deve ser administrado com precaução. A farmacocinética da amlodipina
não foi estudada no compromisso hepático grave. Em doentes com compromisso hepático, a amlodipina deve
ser iniciada na dose mais baixa e titulada lentamente. A utilização de Zolnor em doentes com compromisso
hepático grave está contraindicada.
População pediátrica:
A segurança e eficácia de Zolnor em crianças e
adolescentes com idade inferior a 18 anos não foram ainda estabelecidas. Não existem dados disponíveis.
Modo de administração:
O comprimido deve ser engolido com uma quantidade
suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser
tomado à mesma hora todos os dias.
Contraindicações:
Hipersensibilidade às substâncias ativas, aos derivados
da di-hidropiridina ou a qualquer um dos excipientes. Segundo e terceiro trimestres de gravidez.
Insuficiência hepática grave e obstrução biliar. O uso concomitante de Zolnor com medicamentos contendo
aliscireno é contraindicado em doentes com diabetes mellitus ou compromisso renal (TFG < 60 ml/min./1,73
m
2). Devido ao componente amlodipina, o Zolnor está também contraindicado
em doentes com hipotensão grave, choque (incluindo choque cardiogénico), obstrução do trato de saída do
ventrículo esquerdo (por exemplo, estenose aórtica de grau elevado), insuficiência cardíaca
hemodinamicamente instável após enfarte agudo do miocárdio.
Efeitos indesejáveis:
As reações adversas mais frequentemente notificadas
durante o tratamento com Zolnor são edema periférico (11,3%), cefaleias (5,3%) e tonturas (4,5%). As
reações adversas do Zolnor em ensaios clínicos, estudos de segurança pós-autorização e notificações
espontâneas estão resumidas na tabela abaixo, assim como as reações adversas dos seus componentes
individuais, olmesartan medoxomilo e amlodipina, baseadas no perfil de segurança conhecido destas
substâncias. Foi utilizada a seguinte terminologia para classificar a ocorrência das reações adversas:
muito frequentes (>1/10), frequentes (>1/100, <1/10), pouco frequentes (>1/1.000, <1/100), raras
(>1/10.000, <1/1.000), muito raras (<1/10.000), desconhecida (não pode ser calculado a partir dos dados
disponíveis).
Doenças do sangue e do sistema linfático: Leucopenia: muito rara (Amlodipina). Trombocitopenia:
pouco frequente (Olmesartan), muito rara (Amlodipina).
Doenças do sistema imunitário: Reacção alérgica/hipersensibilidade medicamentosa: rara
(Associação olmesartan/amlodipina), muito rara (Amlodipina). Reacção anafilática: pouco frequente
(Olmesartan).
Doenças do metabolismo e da nutrição: Hiperglicemia: muito rara (Amlodipina). Hipercaliemia:
pouco frequente (Associação olmesartan/amlodipina), rara (Olmesartan). Hipertrigliceridemia: frequente
(Olmesartan). Hiperuricemia: frequente (Olmesartan).
Perturbações do foro psiquiátrico: Confusão: rara (Amlodipina). Depressão: pouco frequente
(Amlodipina). Insónia: pouco frequente (Amlodipina). Irritabilidade: pouco frequente (Amlodipina).
Diminuição da libido: pouco frequente (Associação olmesartan/amlodipina). Alterações do humor (incluido
ansiedade): pouco frequente (Amlodipina).
Doenças do sistema nervoso: Tonturas: frequente (Associação olmesartan/amlodipina, Olmesartan,
Amlodipina). Disgeusia: pouco frequente (Amlodipina). Cefaleias: frequente (Associação
olmesartan/amlodipina, Olmesartan, Amlodipina). Hipertonia: muito raras (Amlodipina). Hipoestesia: pouco
frequente (Associação olmesartan/amlodipina, Amlodipina). Letargia: pouco frequente (Associação
olmesartan/amlodipina). Parestesia: pouco frequente (Associação olmesartan/amlodipina, Amlodipina).
Neuropatia periférica: muito rara (Amlodipina). Tonturas posturais: pouco frequente (Associação
olmesartan/amlodipina).
Perturbações do sono: pouco frequente (Amlodipina). Sonolência: frequente (Amlodipina). Síncope:
rara (Associação olmesartan/amlodipina), pouco frequente (Amlodipina). Tremor: pouco frequente
(Amlodipina). Transtorno extrapiramidal: desconhecido (Amlodipina)
Afeções oculares: Perturbações visuais (incluindo diplopia): Frequente (Amlodipina).
Afecções do ouvido e do labirinto: Acufenos: pouco frequente (Amlodipina). Vertigens: pouco
frequente (Associação olmesartan/amlodipina, Olmesartan).
Cardiopatias: Angina de peito: pouco frequente (Olmesartan, Amlodipina (incl. agravamento da
angina de peito)). Arritmia (incluindo bradicardia, taquicardia ventricular e fibrilhação auricular):
pouco frequente (Amlodipina). Enfarte do miocárdio: muito rara (Amlodipina). Palpitações: pouco
frequente (Associação olmesartan/amlodipina, Amlodipina) frequente (Amlodipina). Taquicardia: pouco
frequente (Associação olmesartan/amlodipina).
Vasculopatias: Hipotensão: pouco frequente (Associação olmesartan/amlodipina), rara (Olmesartan),
pouco frequente (Amlodipina). Hipotensão ortostática: pouco frequente (Associação
olmesartan/amlodipina). Rubor: rara (Associação olmesartan/amlodipina), frequente (Amlodipina).
Vasculite: muito rara (Amlodipina).
Doenças respiratórias, torácicas e do mediastino: Bronquite: frequente (Olmesartan). Tosse: pouco
frequente (Associação olmesartan/amlodipina), frequente (Olmesartan), pouco frequente (Amlodipina).
Dispneia: pouco frequente (Associação olmesartan/amlodipina, Amlodipina). Faringite: frequente
(Olmesartan). Rinite: frequente (Olmesartan), pouco frequente (Amlodipina).
Doenças gastrointestinais: Dor abdominal: frequente (Olmesartan, Amlodipina). Alteração dos
hábitos intestinais (incluindo diarreia e obstipação): frequente (Amlodipina). Obstipação: pouco
frequente (Associação olmesartan/amlodipina). Diarreia: pouco frequente (Associação
olmesartan/amlodipina), frequente (Olmesartan). Xerostomia: pouco frequente (Associação
olmesartan/amlodipina, Amlodipina). Dispepsia: pouco frequente (Associação olmesartan/amlodipina),
frequente (Olmesartan), frequente (Amlodipina). Gastrite: muito rara (Amlodipina). Gastroenterite:
frequente (Olmesartan). Hiperplasia gengival: muito rara (Amlodipina). Náuseas: pouco frequente
(Associação olmesartan/amlodipina), frequente (Olmesartan, Amlodipina). Pancreatite: muito rara
(Amlodipina). Dor abdominal superior: pouco frequente (Associação olmesartan/amlodipina). Vómitos: pouco
frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Enteropatia semelhante a esprue:
muito rara (Olmesartan).
Afeções hepatobiliares: Enzimas hepáticas elevadas: frequente (Olmesartan), muito rara
(principalmente consistentes com um quadro de colestase) (Amlodipina). Hepatite: muito rara
(Amlodipina). Icterícia: muito rara (Amlodipina).
Afeções dos tecidos cutâneos e subcutâneas: Alopécia: pouco frequente (Amlodipina). Edema
angioneurótico: rara (Olmesartan), muito rara (Amlodipina). Dermatite alérgica: pouco frequente
(Olmesartan). Eritema multiforme: muito rara (Amlodipina). Exantema: pouco frequente (Olmesartan,
Amlodipina). Dermatite exfoliativa: muito rara (Amlodipina). Hiperhidrose: pouco frequente (Amlodipina).
Fotosensibilidade: muito rara (Amlodipina). Prurido: pouco frequente (Olmesartan, Amlodipina). Púrpura:
pouco frequente (Amlodipina). Edema de Quincke: muito rara (Amlodipina). Erupção cutânea: pouco
frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Descoloração da pele: pouco
frequente (Amlodipina). Síndrome de Stevens-Johnson: muito rara (Amlodipina). Necrólise epidérmica
tóxica: desconhecido (Amlodipina) Urticária: rara (Associação olmesartan/amlodipina), pouco frequente
(Olmesartan), pouco frequente (Amlodipina).
Afecções musculosqueléticas e dos tecidos conjuntivos: Edema dos tornozelos: frequente
(Amlodipina). Artralgia: Pouco frequente (Amlodipina). Artrite: frequente (Olmesartan). Dorsalgias:
pouco frequente (Associação olmesartan/amlodipina), frequente (Olmesartan), pouco frequente
(Amlodipina). Espasmos musculares: pouco frequente (Associação olmesartan/amlodipina), rara
(Olmesartan), frequente (Amlodipina). Mialgia: pouco frequente (Olmesartan, Amlodipina). Dores nas
extremidades: pouco frequente (Associação olmesartan/amlodipina). Dor esquelética: frequente
(Olmesartan).
Doenças renais e urinárias: Insuficiência renal aguda: rara (Olmesartan). Hematúria frequente
(Olmesartan). Aumento da frequência urinária: pouco frequente (Amlodipina). Perturbações da micção:
pouco frequente (Amlodipina). Nictúria: pouco frequente (Amlodipina). Polaquiúria: pouco frequente
(Associação olmesartan/amlodipina). Insuficiência renal: rara (Olmesartan). Infecção do tracto urinário:
frequente (Olmesartan).
Doenças dos órgãos genitais e da mama: Disfunção eréctil/impotência: pouco frequente (Associação
olmesartan/amlodipina, Amlodipina). Ginecomastia: pouco frequente (Amlodipina).
Perturbações gerais e alterações no local de administração: Astenia: pouco frequente (Associação
olmesartan/amlodipina, Olmesartan), frequente (Amlodipina). Dor torácica: frequente (Olmesartan), pouco
frequente (Amlodipina). Edema facial: rara (Associação olmesartan/amlodipina), pouco frequente
(Olmesartan). Fadiga: frequente (Associação olmesartan/amlodipina, Olmesartan, Amlodipina). Sintomas do
tipo gripal: frequente (Olmesartan). Letargia: rara (Olmesartan). Mal-estar: pouco frequente
(Olmesartan, Amlodipina). Edema: frequente (Associação olmesartan/amlodipina), muito frequente
(Amlodipina). Dor: frequente (Olmesartan), pouco frequente (Amlodipina). Edema periférico: frequente
(Associação olmesartan/amlodipina, Olmesartan). Edema “pitting”: frequente (Associação
olmesartan/amlodipina).
Exames complementares de diagnóstico: Aumento da creatinina no sangue: pouco frequente
(Associação olmesartan/amlodipina), rara (Olmesartan). Aumento da creatina-fosfoquinase no sangue:
frequente (Olmesartan). Diminuição do potássio no sangue: pouco frequente (Associação
olmesartan/amlodipina). Aumento da ureia no sangue: frequente (Olmesartan). Aumento do ácido úrico no
sangue: pouco frequente (Associação olmesartan/amlodipina). Aumento da gama glutamil transferase: pouco
frequente (Associação olmesartan/amlodipina). Diminuição de peso: pouco frequente (Amlodipina). Aumento
de peso: pouco frequente (Amlodipina). Foram notificados casos singulares de rabdomiólise em associação
temporal com a toma de bloqueadores dos recetores da angiotensina II. Pede-se aos profissionais de saúde
que notifiquem quaisquer suspeitas de reações adversas diretamente ao Infarmed, I.P. Sítio da internet:
http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente); Tel: +351 21 798 73 73; Linha do
Medicamento: 800222444 (gratuita); Fax: + 351 21 798 73 97; E-mail: farmacovigilancia@infarmed.pt
Titular da Autorização de Introdução no Mercado
(A.I.M.): Menarini
International Operations Luxembourg S.A., 1, Avenue de la Gare, L-1611 Luxembourg _ Luxemburgo.
Representante Local do Titular da A.I.M.: A. Menarini Portugal – Farmacêutica, S.A., Quinta da Fonte,
Edifício D. Manuel I, Piso 2 - A, Rua dos Malhões nº. 1, 2770-071 Paço de Arcos, Portugal, Tel: +351 210
935 500. Informações revistas em Setembro de 2022. Para mais informações deverá contactar o
representante local do
Titular da Autorização de Introdução no Mercado:
A. Menarini Portugal –
Farmacêutica, S.A. Medicamento sujeito a receita médica. Escalão B (Regime Geral 69%). Refª. 09/2022
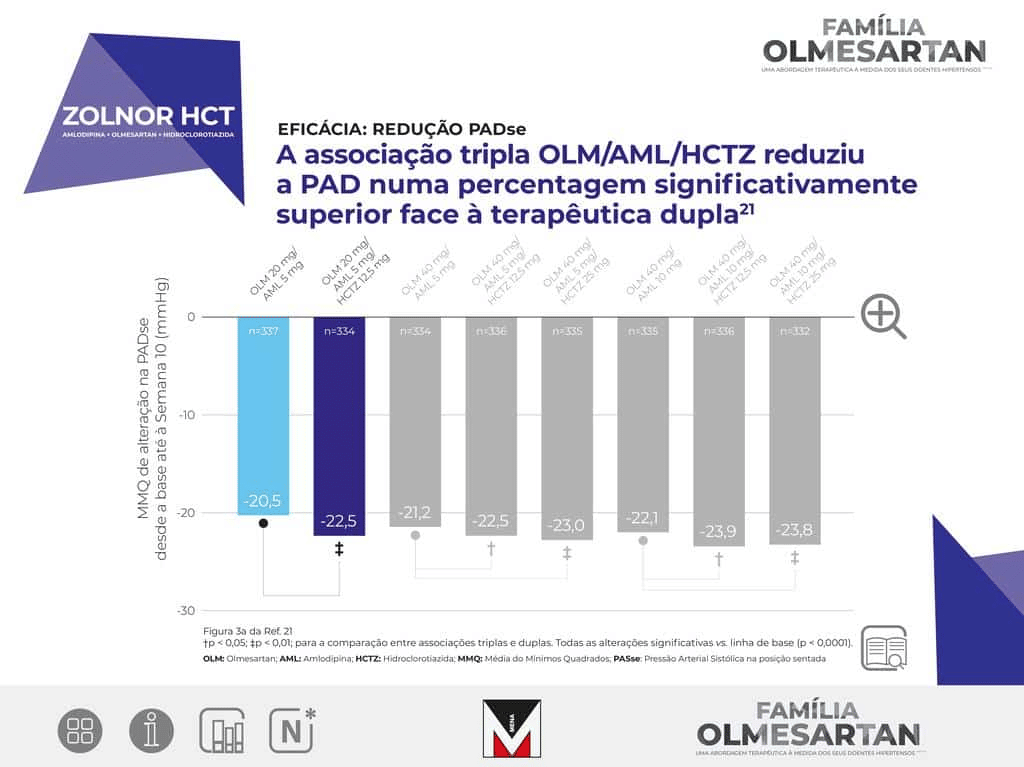
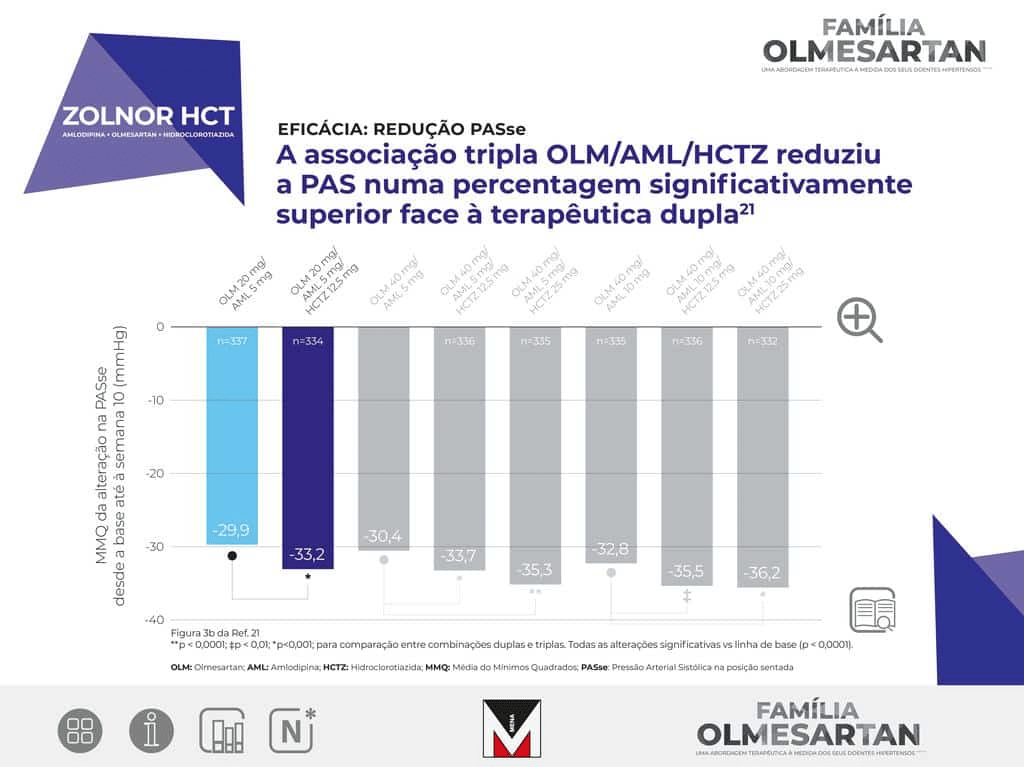
ZOLNOR HCT
Informações Essenciais Compatíveis com o RCM
NOME DO MEDICAMENTO
Zolnor HCT 20 mg + 5 mg + 12,5 mg comprimidos
revestidos por película
COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
Cada comprimido revestido por
película de Zolnor HCT contém 20 mg de olmesartan medoxomilo, 5 mg de amlodipina (como besilato de
amlodipina) e 12,5 mg de hidroclorotiazida.
FORMA FARMACÊUTICA
Comprimido revestido por película. Cor laranja clara,
forma redonda, comprimido revestido por película de 8 mm com C51 gravado num dos lados.
INFORMAÇÕES CLÍNICAS Indicações terapêuticas:
Tratamento da hipertensão
essencial. Terapêutica adjuvante: Zolnor HCT está indicado em doentes adultos cuja tensão arterial não
está adequadamente controlada com a combinação olmesartan medoxomilo e amlodipina tomados através de uma
formulação de dois componentes. Terapêutica de substituição: Zolnor HCT está indicado como terapêutica
de substituição em doentes adultos cuja tensão arterial está adequadamente controlada com a combinação
olmesartan medoxomilo, amlodipina e hidroclorotiazida, tomados através de uma formulação com dois
componentes (olmesartan medoxomilo e amlodipina ou olmesartan modoxomilo e hidroclorotiazida) e uma
formulação de um componente (hidroclorotiazida ou amlodipina).
Posologia: Adultos:
A posologia recomendada de Zolnor HCT é de um
comprimido por dia.
Terapêutica adjuvante: Zolnor HCT 20 mg + 5 mg + 12,5 mg pode ser
administrado em doentes cuja tensão arterial não está adequadamente controlada com olmesartan medoxomilo
20 mg e amlodipina 5 mg tomados através de uma formulação de dois componentes. Recomenda-se a titulação
gradual da dose dos componentes individuais antes da mudança para a combinação tripla. Quando
clinicamente apropriado pode ser considerada uma mudança direta da formulação de dois componentes para a
combinação tripla.
Terapêutica de substituição: Os doentes controlados com doses estáveis de
olmesartan medoxomilo, amlodipina e hidroclorotiazida tomados ao mesmo tempo, através de uma formulação
com dois componentes (olmesartan medoxomilo e amlodipina ou olmesartan medoxomilo e hidroclorotiazida) e
uma formulação de um componente (hidroclorotiazida ou amlodipina) podem mudar para Zolnor HCT contendo
os componentes nas mesmas doses. A dose máxima de Zolnor HCT é de 40 mg + 10 mg + 25 mg por dia.
Idosos (idade igual ou superior a 65 anos):
em doentes idosos é
recomendada
precaução, incluindo uma monitorização mais frequente da tensão arterial, particularmente com a dosagem
máxima de Zolnor HCT de 40 mg + 10 mg + 25 mg por dia. Um aumento de dosagem em idosos deve ser efetuado
com precaução. Estão disponíveis dados muito limitados sobre o uso de Zolnor HCT em doentes com idade
igual ou superior a 75 anos. Recomenda-se extrema precaução, incluindo uma monitorização mais frequente
da tensão arterial.
Compromisso renal:
A dose máxima em doentes com compromisso renal ligeiro
a moderado (depuração da creatinina 30-60 ml/min) é Zolnor HCT 20 mg + 5 mg + 12,5 mg, devido à
experiência limitada com dose de 40 mg de olmesartan medoxomilo neste grupo de doentes. É aconselhável a
monitorização das concentrações séricas de potássio e de creatinina em doentes com compromisso renal
moderado. A utilização de Zolnor HCT em doentes com compromisso renal grave (depuração da creatinina <30
ml/min) está contraindicada.
Compromisso hepático:
Zolnor HCT deve ser usado com precaução em doentes
com compromisso hepático ligeiro. Em doentes com compromisso hepático moderado, a dose máxima não deve
exceder Zolnor HCT 20 mg + 5 mg + 12,5 mg uma vez por dia. É aconselhável uma monitorização cuidadosa da
tensão arterial e da função renal em doentes com compromisso hepático. Como acontece com todos os
antagonistas dos canais de cálcio, a semivida da amlodipina é prolongada em doentes com compromisso
hepático, não tendo sido estabelecidas recomendações posológicas. Consequentemente, Zolnor HCT deve ser
administrado com precaução nestes doentes. A farmacocinética da amlodipina não foi estudada no
compromisso hepático grave. Em doentes com compromisso hepático, a amlodipina deve ser iniciada na dose
mais baixa e titulada lentamente. A utilização de Zolnor HCT está contraindicada em doentes com
compromisso hepático grave, colestase ou obstrução biliar.
População pediátrica:
Zolnor HCT não é recomendado em doentes com idade
inferior a 18 anos devido á ausência de dados de segurança e eficácia.
Modo de administração:
O comprimido deve ser engolido com uma quantidade
suficiente de líquido (por exemplo, um copo de água). O comprimido não deve ser mastigado e deve ser
tomado à mesma hora todos os dias. Zolnor HCT pode ser tomado com ou sem alimentos.
Contraindicações:
Hipersensibilidade às substâncias ativas, aos derivados
da di-hidropiridina ou a substâncias derivadas da sulfonamida (dado que a hidroclorotiazida é um fármaco
derivado da sulfonamida) ou a qualquer dos excipientes. Compromisso renal grave. Hipocaliemia
refractária, hipercalcemia, hiponatremia e hiperuricemia sintomática. Insuficiência hepática grave,
colestase e afeções biliares obstrutivas. Segundo e terceiro trimestres de gravidez. O uso concomitante
de Zolnor HCT com medicamentos contendo aliscireno é contraindicado em doentes com diabetes mellitus ou
compromisso renal (TFG < 60 ml/min./1,73 m
2). Devido ao componente
amlodipina, Zolnor HCT está contraindicado em doentes com: choque (incluindo choque cardiogénico),
hipotensão grave, obstrução do trato de saída do ventrículo esquerdo (por exemplo, estenose aórtica de
grau elevado), insuficiência cardíaca hemodinamicamente instável após enfarte agudo do miocárdio.
Efeitos indesejáveis:
A segurança de Zolnor HCT foi estudada em ensaios
clínicos em 7826 doentes a receber olmesartan medoxomilo em combinação com amlodipina e
hidroclorotiazida. As reações adversas provenientes de ensaios clínicos, estudos de segurança
pós-autorização e notificação espontânea estão resumidas na tabela 1 para Zolnor HCT bem como para os
componentes individuais olmesartan medoxomilo, amlodipina e hidroclorotiazida com base no perfil de
segurança conhecido de cada componente individual. As reações adversas notificadas mais frequentemente
durante o tratamento com Zolnor HCT são edema periférico, cefaleias e tonturas. Foi utilizada a seguinte
terminologia para classificar a ocorrência de efeitos indesejáveis: muito frequentes (≥1/10), frequentes
(≥1/100, <1/10), pouco frequentes (≥1/1.000, <1/100), raros (≥1/10.000, <1/1.000), muito raros
(<1/10.000), desconhecida (não pode ser calculado a partir dos dados disponíveis).

* Na experiência pós-comercialização foram reportados casos de hepatite autoimune, com período de
latência de alguns meses a anos, que foram reversíveis após a descontinuação da terapêutica com
olmesartan.
Foram notificados casos isolados de rabdomiólise em associação temporal com a toma de bloqueadores dos
recetores da angiotensina II. Outras reações adversas notificadas em ensaios clínicos ou provenientes da
experiência pós com uma combinação de dose fixa de olmesartan medoxomilo e amlodipina, e ainda não
notificadas para Zolnor HCT, olmesartan medoxomilo em monoterapia ou amlodipina em monoterapia ou
notificadas com uma frequência mais elevada para a combinação dupla (Tabela 2):

Outras reações adversas notificadas em ensaios clínicos ou provenientes da experiência pós
comercialização com uma combinação de dose fixa de olmesartan medoxomilo e hidroclorotiazida, e ainda
não notificadas para Zolnor HCT, olmesartan medoxomilo em monoterapia ou hidroclorotiazida em
monoterapia ou notificadas com uma frequência mais elevada para a combinação dupla (Tabela 3):

Cancro da pele não-melanoma: Com base nos dados disponíveis de estudos epidemiológicos observou-se uma
associação entre a HCTZ e o NMSC, dependente da dose cumulativa.
Pede-se aos profissionais de saúde que notifiquem quaisquer suspeitas de reações adversas diretamente ao
Infarmed, I.P. (Sítio da internet: http://www.infarmed.pt/web/infarmed/submissaoram (preferencialmente)
ou através dos seguintes contactos: Direção de Gestão do Risco de Medicamentos Parque da Saúde de
Lisboa, Av. Brasil 53 1749-004 Lisboa; Tel: +351 21 798 73 73; Linha do Medicamento: 800222444
(gratuita); E-mail: farmacovigilancia@infarmed.pt
Titular da Autorização de Introdução no Mercado (A.I.M.):b> Menarini International Operations
Luxembourg S.A., 1, Avenue de la Gare, L-1611 Luxembourg, Luxemburgo.
Representante Local do Titular
da A.I.M.:b> A. Menarini Portugal – Farmacêutica, S.A., Quinta da Fonte, Edifício D. Manuel I,
Piso 2 - A, Rua dos Malhões nº. 1, 2770-071 Paço de Arcos, Portugal, Tel: +351 210 935 500.
Informações revistas em Setembro de 2022 Para mais informações deverá contactar o representante local do
Titular da Autorização de Introdução no Mercado: A. Menarini Portugal – Farmacêutica, S.A. Medicamento
sujeito a receita médica. Medicamento Comparticipado – Escalão B (Regime Geral 69%).
Refª. 09/2022















 * Na experiência pós-comercialização foram reportados casos de hepatite autoimune, com período de
latência de alguns meses a anos, que foram reversíveis após a descontinuação da terapêutica com
olmesartan.
* Na experiência pós-comercialização foram reportados casos de hepatite autoimune, com período de
latência de alguns meses a anos, que foram reversíveis após a descontinuação da terapêutica com
olmesartan.